
图1 文章标题
组织是生物医学研究中常见的标本,临床组织标本的组织形态学检查是诊断大多数癌症的主要方法。新兴的组学技术可以对组织标本中的分子调控进行全面的研究,除了揭示潜在的治疗靶点外,还为疾病的发病机制提供了系统的见解。基于质谱的定量蛋白质组学可以识别和定量在各种组织标本中表达的数千种蛋白质,特别是应用于已经灭菌的石蜡组织,为感染性疾病的诊断和治疗提供了宝贵的信息。
临床样本是不可再生的珍贵资源,极具疾病研究价值。临床蛋白质组学可对临床样本的蛋白质分子进行全面研究,传统样本的前处理方法难以满足高通量和高稳健性需求,无法保证蛋白质组学分析可重复性。2022年8月5号,西湖大学郭天南团队在Nature Protocols上发表了一篇名为《High-throughput proteomic sample preparation using pressure cycling technology》的文章。该文章详细描述了基于特色的压力循环技术(PCT,pressure cycling technology)的样本制备流程。该流程可实现低至 0.1 mg 极微量组织以及针对细胞、粪便、泪液试纸等样本的高通量前处理,并且所得到的肽段可以兼容各种质谱蛋白质组学分析方法的目标。
压力循环技术 (PCT)
压力循环技术辅助的蛋白质组学样品制备方法将交替高压应用于PCT专用耐压管(PCT-MicroTube)中的样品(图2)。循环压力促进组织裂解和酶促反应。PCT在Barocycler®中实现(图2),引入周期性的压力振荡,通过交替超高压(高达45,000 psi)和常压加速蛋白质水解,从活检组织中获得高产量且可重复性强的多肽样本。所有反应都发生在同一管中,因此该方法可以更好的保留蛋白组信息。

图2 PCT专用微量耐压管及配套的盖子,研磨器,处理盖子的工具,支架和压力循环装置的照片。
基于PCT的样本制备方法的优化历程
2015年,郭天南团队在 Nature Medicine上发表了一篇基于PCT样本制备流程方法用于蛋白质组学的文章,在6-8小时内即可制备6个新鲜组织样本。与传统的过夜酶解法相比,不仅缩短了样本前处理的时间,同时也将多肽回收率提高了约60%。并且评估了该方法所需的最低样本量为大约50,000个人类细胞和0.2-0.5 mg新鲜小鼠或人类组织样本。在此基础上,我们进一步开发了一种PCT专用的研磨设备(MicroPestle,图2),其应用于不同类型的组织样本时,可将多肽回收率提高20%-40%。后续改进的Barocycler® (图2)仪器和优化的工作流程可同时处理16个样品。2017年,我们将该方法改良,可应用于福尔马林固定、石蜡包埋(FFPE,formalin-fixed, paraffin-embedded)组织。2020年,我们将组织样本的处理时间从4.5h缩短到了2.5h(图3),与传统的四步法相比,具有更高的通量和多肽产率。
基于PCT的具体工作流程
我们提出了一种优化的工作流程,利用PCT辅助制备组织样本,对组织进行高通量蛋白质组分析(图3)。该方案的最低样本用量为0.1 mg组织或5000个细胞。因此可用于分析微量临床标本,包括组织、细胞、粪便和泪液试纸等(图3)。这些样本可来自不同物种,如人类、小鼠或大鼠。该工作流程适用于大型临床队列的微量组织样本研究。
本篇文章详细提供了两种样品制备方案。第一种方案是基于PCT改进的传统方法,包括四个主要步骤(图3,工作流程A)。我们使用6 M尿素和2 M硫脲作为裂解缓冲液,在PCT的辅助下提取蛋白质,在组织裂解和蛋白质提取后,用10 mM的Tris(2-羧乙基)膦(TCEP, tris(2-carboxyethyl)phosphine)和40 mM碘乙酰胺(IAA, Iodoacetamide)对二硫键还原和烷基化。接着,将胞内蛋白酶(酶与底物比1:40)和胰蛋白酶(酶与底物比1:50)分两步加入上述混合物中,进行PCT辅助酶解。另一种方案是基于PCT的两步法(图3,工作流程B),第一步合并了PCT辅助的裂解、还原和烷基化,第二步合并了PCT辅助的胞内蛋白酶/胰蛋白酶酶解。胞内蛋白酶和胰蛋白酶的最佳酶与底物比分别为1:80和1:20。与传统的四步法相比,两步法具有较高的通量和多肽产量与相当的漏切率。
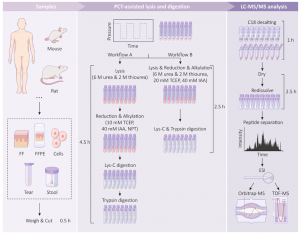
图3 PCT的蛋白样品制备的高效实验流程
方法的优势与局限性
与其他蛋白质组学样品制备方法相比,该方法的主要优点包括能够处理微量的组织,具有高多肽回收率、高重现性、半自动化和高稳定性。这些对于大规模队列研究的高通量蛋白质组定量是至关重要的。因为所有反应都发生在同一管中,从而最大限度的减少蛋白的损失。数据显示,与传统的过夜消化相比,该方法提取的膜蛋白百分比更高。一项用该方法制备的超过20种类型人体组织的蛋白质组可鉴定到超过10000种的蛋白,并且没有显示对某种蛋白质有检测偏好性。
该样本制备方法适用于所有类型的新鲜组织和石蜡包埋组织样本,但不一定是所有类型的最佳选择。它适用于重量在0.1-2 mg之间的微量组织,特别有利于在溶液中难以水解消化的致密组织。该方法还可以有效地分析激光辅助显微解剖制备的组织。但重量超过2 mg的组织不能被有效处理,除非被分成最佳重量的样本。该方案对血浆、血清和尿液等液体样本的制备优势不大除非它们固定于试纸上。目前该方法仍是半自动化的,需要进一步发展到完全自动化,而且该方法的一个较大限制因素是需要使用到 Barocycler 这一特殊的仪器设备。
组织样本数据展示
在本研究中,测试的组织样本来源于6个月的 C57BL6 雄性小鼠的肾脏和16名癌症患者。小鼠肾脏样本的蛋白质组结果显示,约1 mg的新鲜组织、石蜡打孔样本可回收100 µg左右的多肽,20 µm厚的石蜡FFPE切片可回收50 µg左右的多肽(图4 a),三种样本的多肽漏切率中位数分别为25.25%、28.04%和23.44%(图4 b)。使用60分钟DDA可鉴定到平均约4000个蛋白质(图4 c),并且以上三类样本的生物学重复样本的蛋白定量结果的皮尔逊相关系数(r)分别为0.77、0.75和0.85 (图4 d)。
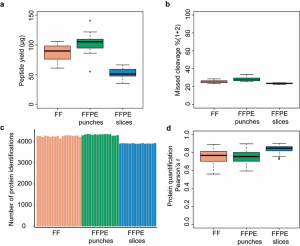
图4 小鼠肾脏组织样本的测试结果数据
a,18个新鲜、15 石蜡打孔(各0.8-1.2mg)样本和15个石蜡切片(20 µm)样本的多肽回收率。b,多肽漏切率。c,每个组织样本用500 ng肽,60分钟DDA方法鉴定到的蛋白数。d,PD软件定量的蛋白质皮尔逊相关系数(r)。
本研究将该方法应用于包括肾脏、结肠、肺、舌、胰腺、睾丸、胃和甲状腺的8种非肿瘤组织,共获得了每毫克组织中最低 25 µg(胃)、最高 142 µg(胰腺)的肽段产量。对于这 8 种组织的 32 个石蜡组织样本(肿瘤和非肿瘤配对样本对)提取的肽段采用PulseDIA PASEF方法并用DIA-NN软件分析,可鉴定得到中位数为7991的蛋白数和75069的多肽数。
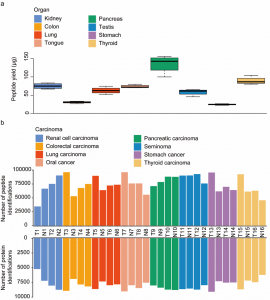
图5.基于PCT样品制备方法在人类肿瘤组织样本中的应用
a, 8种类型的组织(0.8-1.2mg)的4个生物重复的多肽回收率。b,从16例癌症患者中收集的32个石蜡组织样本(肿瘤和非肿瘤配对样本)的多肽和蛋白鉴定数量。这些样本来自8种不同类型的组织。
文章小结
该文章报道的基于 PCT 的样本制备优化流程,可实现低至 0.1mg 极微量组织以及针对细胞、粪便、泪液试纸等样本的高通量前处理过程,方法具备高重现性,高稳定性以及高稳健性。该方法流程非常适合针对微量石蜡样本和活检穿刺样本的临床大队列样本的蛋白组学样本制备。
应用该方法的代表性文章
Guo, T. et al. Nat. Med. 21, 407–413 (2015): https://doi.org/10.1038/nm.3807
Zhu, Y. et al. Mol. Oncol. 13, 2305–2328 (2019): https://doi.org/10.1002/1878-0261.12570
Shao, W. et al. Nat. Commun. 10, 2524 (2019): https://doi.org/10.1038/s41467-019-10513-5
Charmpi, K. et al. Genome Biol. 21, 302 (2020): https://doi.org/10.1186/s13059-020-02188-9
Nie, X. et al. Cell 184, 775–791.e714 (2021): https://doi.org/10.1016/j.cell.2021.01.004
